Fosforija ir luminiscence, kas notiek, kad enerģija piegādā elektromagnētiskā radiācija, parasti ultravioletā gaisma. Enerģijas avots izstaro atoms no zemākas enerģijas stāvokļa uz "satrauktu" augstākas enerģijas stāvokli; tad elektrons atbrīvo enerģiju formā redzamā gaisma (luminiscence), kad tā atgriežas zemākas enerģijas stāvoklī.
Taustiņu paņēmieni: fosforizēšana
- Fosforescence ir fotoluminiscences veids.
- Fosforescencē gaisma tiek absorbēta materiālā, palielinot elektronu enerģijas līmeņus ierosinātā stāvoklī. Tomēr gaismas enerģija ne tuvu neatbilst pieļaujamo ierosināto stāvokļu enerģijai, tāpēc absorbētās fotogrāfijas iestrēgst trīskāršā stāvoklī. Pārejas uz zemāku un stabilāku enerģijas stāvokli prasa laiku, bet, kad tie notiek, gaisma tiek atbrīvota. Tā kā šī izdalīšanās notiek lēnām, šķiet, ka fosforējošs materiāls kvēlojas tumsā.
- Fosforesošo materiālu piemēri ir tumsā mirdzošas zvaigznes, dažas drošības zīmes un kvēlojoša krāsa. Atšķirībā no fosforējošiem produktiem, fluorescējošie pigmenti pārstāj kvēlot, kad gaismas avots ir noņemts.
- Lai arī fosfors ir nosaukts par fosfora zaļo mirdzumu, tas faktiski oksidējas. Tas nav fosforošs!
Vienkāršs skaidrojums
Fosporācija laika gaitā lēnām atbrīvo uzkrāto enerģiju. Pamatā fosforējošais materiāls tiek "uzlādēts", pakļaujot to gaismai. Tad enerģija tiek glabāta noteiktu laiku un lēnām izdalās. Kad enerģija tiek atbrīvota tūlīt pēc krītošās enerģijas absorbcijas, process tiek izsaukts fluorescence.
Kvantu mehānikas skaidrojums
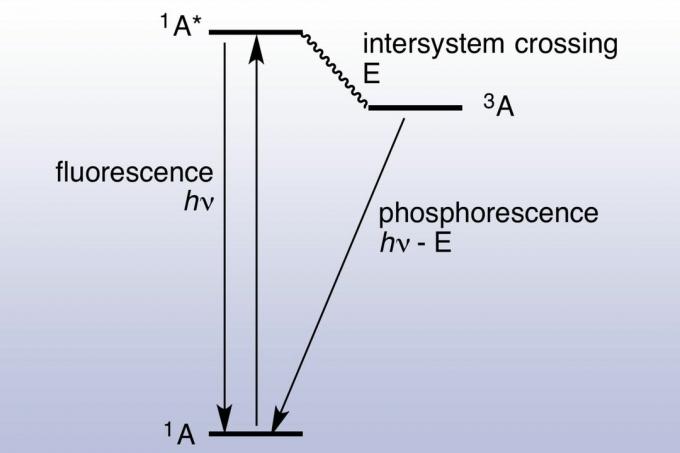
Fluorescences apstākļos virsma gandrīz uzreiz (apmēram 10 nanosekundēs) absorbē un atkārtoti izstaro fotonu. Fotoluminiscence ir ātra, jo absorbēto fotonu enerģija sakrīt ar enerģijas stāvokļiem un pieļaujamajām materiāla pārejām. Fosporācija ilgst daudz ilgāk (milisekundēs līdz dienām), jo absorbētais elektrons šķērso satrauktā stāvoklī ar lielāku griezienu daudzkārtību. Uzbudinātie elektroni tiek ieslodzīti trīskāršā stāvoklī un var izmantot tikai "aizliegtas" pārejas, lai nokristu zemākā enerģijas singletā stāvoklī. Kvantu mehānika pieļauj aizliegtu pāreju, taču tie nav kinētiski labvēlīgi, tāpēc to parādīšanās prasa ilgāku laiku. Ja ir absorbēts pietiekami daudz gaismas, uzkrātā un atbrīvotā gaisma kļūst pietiekami nozīmīga, lai materiāls varētu "mirdzēt tumšs. "Šī iemesla dēļ fosforējoši materiāli, tāpat kā fluorescējoši materiāli, melnā (ultravioletā) gaismā parādās ļoti spilgti. Jablonski diagramma parasti tiek izmantota, lai parādītu atšķirību starp fluorescenci un fosforescenci.
Vēsture
Fosporējošo materiālu pētījums aizsākās vismaz 1602. gadā, kad itālis Vincenzo Casciarolo aprakstīja “lapis solaris” (saules akmens) vai “lapis lunaris” (mēness akmens). Atklājums tika aprakstīts filozofijas profesora Giulio Cesare la Galla 1612. gada grāmatā De fenomens Orbe Lunae. La Galla ziņo, ka Casciarolo akmens izstaroja gaismu pēc tam, kad tas bija pārkaļķojies karsējot. Tas saņēma gaismu no Saules un pēc tam (tāpat kā Mēness) izstaroja gaismu tumsā. Akmens bija netīrs barīts, lai arī citiem minerāliem ir arī fosforescencija. Tie ietver dažus dimanti (pazīstams Indijas karalis Bhoja jau 1010-1055. gadā, no jauna atklājis Alberts Magnuss un atkal no jauna atklājis Roberts Boils) un baltais topāzs. Īpaši ķīnieši novērtēja fluorīta veidu, ko sauc par hlorofānu un kas parādītu luminiscenci ķermeņa karstumā, gaismas iedarbībā vai tiktu noberzts. Interese par fosforescences un cita veida luminiscences raksturu galu galā noveda pie radioaktivitātes atklāšanas 1896. gadā.
Materiāli
Papildus dažiem dabīgiem minerāliem fosforizāciju rada ķīmiski savienojumi. Droši vien vispazīstamākais no tiem ir cinka sulfīds, ko izstrādājumos izmanto kopš 30. gadiem. Cinka sulfīds parasti izstaro zaļu fosforu, lai arī gaismas krāsas maiņai var pievienot fosforus. Fosfori absorbē fosforizētās gaismas izstaroto gaismu un pēc tam izdala to kā citu krāsu.
Pavisam nesen fosforizēšanai tiek izmantots stroncija alumināts. Šis savienojums desmit reizes mirdz spožāk nekā cinka sulfīds, kā arī daudz ilgāk saglabā savu enerģiju.
Fosporācijas piemēri
Bieži sastopami fosforescences piemēri ir zvaigznes, ko cilvēki uzliek uz guļamistabas sienām, kuras stundām ilgi mirdz pēc gaismas ieslēgšanas, un krāsu, ko izmanto kvēlojošu zvaigžņu sienas gleznojumu izgatavošanai. Kaut arī elements fosfors iedegas zaļā krāsā, gaisma tiek atbrīvota no oksidācijas (ķīmiski luminiscences) un ir nē fosforescences piemērs.
Avoti
- Francs, Kārlis A.; Kehrs, Volfgangs G.; Siggels, Alfrēds; Wieczoreck, Jürgen; Ādams, Valdemārs (2002). "Luminiscējošie materiāli" Ulmana rūpnieciskās ķīmijas enciklopēdija. Vailijs-VČ. Veinheima. doi: 10.1002 / 14356007.a15_519
- Roda, Aldo (2010). Ķīmiskā luminiscence un bioluminiscence: pagātne, tagadne un nākotne. Karaliskā ķīmijas biedrība.
- Zitoun, D.; Bernaud, L.; Manteghetti, A. (2009). Ilgstoša fosfora sintēze mikroviļņu krāsnī. Dž. Chem. Izglītība. 86. 72-75. doi: 10.1021 / ed086p72