A monosaharīds vai vienkāršs cukurs ir ogļhidrāti tas nevar būt hidrolizēts mazākos ogļhidrātos. Tāpat kā visi ogļhidrāti, monosaharīds sastāv no trim ķīmiskiem elementiem: oglekļa, ūdeņradis un skābeklis. Tas ir vienkāršākais ogļhidrātu molekulu tips un bieži kalpo par pamatu sarežģītāku molekulu veidošanai.
Monosaharīdi ietver aldozes, ketozes un to atvasinājumus. Monosaharīda vispārējā ķīmiskā formula ir CnH2nOnvai (CH2O)n. Monosaharīdu piemēri ietver trīs visizplatītākās formas: glikoze (dekstroze), fruktoze (levuloze) un galaktoze.
Galvenās izņemtās preces: monosaharīdi
- Monosaharīdi ir mazākās ogļhidrātu molekulas. Tos nevar sadalīt vienkāršākos ogļhidrātos, tāpēc tos sauc arī par vienkāršiem cukuriem.
- Monosaharīdu piemēri ir glikoze, fruktoze, riboze, ksiloze un mannoze.
- Divas galvenās monosaharīdu funkcijas ķermenī ir enerģijas uzkrāšana un kā sarežģītāku cukuru, kas tiek izmantoti kā struktūras elementi, celtniecības bloki.
- Monosaharīdi ir kristāliskas cietās vielas, kas šķīst ūdenī un parasti ir saldas garšas.
Īpašības
Tīrā veidā monosaharīdi ir kristāliski, ūdenī šķīstoši, bezkrāsaini cietās vielas. Monosaharīdiem ir salda garša, jo OH grupas orientācija mijiedarbojas ar garšas receptoriem mēlē, kas nosaka saldumu. Caur dehidratācijas reakciju divi monosaharīdi var veidot disaharīds, trīs līdz desmit var veidot oligosaharīdu, un vairāk nekā desmit var veidot oligosaharīdu polisaharīds.
Funkcijas
Monosaharīdi šūnā pilda divas galvenās funkcijas. Tos izmanto enerģijas uzkrāšanai un ražošanai. Glikoze ir īpaši svarīga enerģijas molekula. Enerģija tiek atbrīvota, kad tās ķīmiskās saites ir sadalītas. Monosaharīdus izmanto arī kā celtniecības blokus, lai veidotu sarežģītākus cukurus, kas ir svarīgi struktūras elementi.
Struktūra un nomenklatūra
Ķīmiskā formula (CH2O)n norāda, ka monosaharīds ir oglekļa hidrāts. Tomēr ķīmiskā formula nenorāda oglekļa atoma izvietojumu molekulā vai cukura hirāliņu. Monosaharīdus klasificē, pamatojoties uz to, cik daudz oglekļa atomu tie satur, karbonilgrupas izvietojumu un to stereoķīmiju.
n ķīmiskajā formulā norāda oglekļa atomu skaitu monosaharīdā. Katrs vienkāršais cukurs satur trīs vai vairāk oglekļa atomus. Tos klasificē pēc oglekļa atomu skaita: triozes (3), tetrozes (4), pentozes (5), heksozes (6) un heptozes (7). Ņemiet vērā, ka visas šīs klases tiek nosauktas ar galotni -ose, norādot, ka tās ir ogļhidrāti. Glicerialdehīds ir triozes cukurs. Eritroze un treoze ir tetrozes cukuru piemēri. Riboze un ksiloze ir pentozes cukuru piemēri. Visizplatītākie vienkāršie cukuri ir heksozes cukuri. Tajos ietilpst glikoze, fruktoze, mannoze un galaktoze. Sedoheptuloze un mannoheptuloze ir heptozes monosaharīdu piemēri.
Aldozēm ir vairāk nekā viena hidroksilgrupa (-OH) un karbonilgrupa (C = O) pie oglekļa gala, savukārt ketozēm ir hidroksilgrupa un karbonilgrupa, kas piestiprināta pie otrā oglekļa atoma.
Klasifikācijas sistēmas var apvienot, lai aprakstītu vienkāršu cukuru. Piemēram, glikoze ir aldoheksoze, savukārt riboze ir ketoheksoze.
Lineārs vs. Ciklisks
Monosaharīdi var pastāvēt kā taisnas ķēdes (acikliskas) molekulas vai kā gredzeni (cikliski). Taisnas molekulas ketonu vai aldehīdu grupa var atgriezeniski reaģēt ar hidroksilgrupu uz citas oglekļa, veidojot heterociklisku gredzenu. Gredzenā skābekļa atoms savieno divus oglekļa atomus. Gredzeni, kas izgatavoti no pieciem atomiem, tiek saukti par furanozes cukuriem, savukārt tie, kas sastāv no sešiem atomiem, ir piranozes forma. Dabā līdzsvara stāvoklī pastāv taisnas ķēdes, furanozes un piranozes formas. Saukšana par molekulu par “glikozi” varētu attiekties uz taisnas ķēdes glikozi, glikofuranozi, glikopiranozi vai formu maisījumu.

Stereoķīmija
Monosaharīdiem piemīt stereoķīmija. Katrs vienkāršais cukurs var būt D- (dextro) vai L- (levo) formā. D- un L-formas ir viens otra spoguļattēli. Dabiskie monosaharīdi ir D-formā, savukārt sintētiski ražoti monosaharīdi parasti ir L-formā.
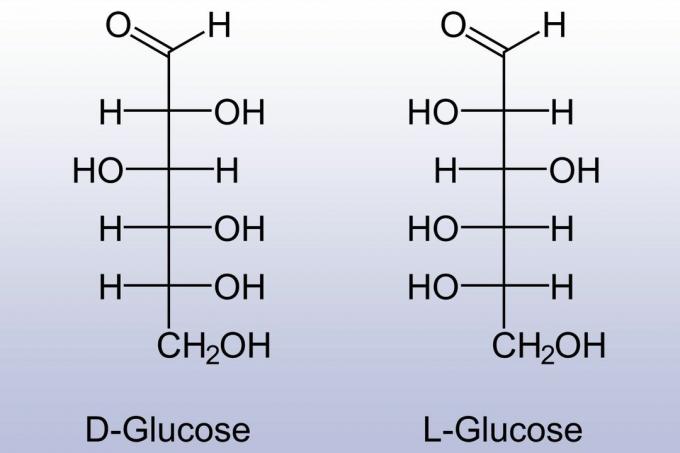
Cikliskajiem monosaharīdiem ir arī stereoķīmija. -OH grupa, kas aizvieto skābekli no karbonilgrupas, var būt vienā no divām pozīcijām (parasti vilkta virs vai zem gredzena). Izomērus norāda, izmantojot priedēkļus α- un β-.
Avoti
- Fearon, W.F. (1949). Ievads bioķīmijā (2. izd.). Londona: Heinemann. ISBN 9781483225395.
- IUPAC (1997) Ķīmiskās terminoloģijas apkopojums (2. izd.). Sastādījis Ā. D. McNaught un A. Vilkinsons. Blekvelas zinātniskās publikācijas. Oksforda. doi: 10.1351 / zelta grāmata. M04021 ISBN 0-9678550-9-8.
- Makmūrijs, Džons. (2008). Organiskā ķīmija (7. izd.). Belmonta, Kalifornija: Thomson Brooks / Cole.
- Pigman, W.; Hortons, D. (1972). "1. nodaļa: Monosaharīdu stereoķīmija". In Pigman and Horton (ed.). Ogļhidrāti: ķīmija un bioķīmija, Vol. 1A (2. izd.). Sandjego: Akadēmiskā prese. ISBN 9780323138338.
- Solomon, E.P.; Bergs, L.R.; Martins, D.W. (2004). Bioloģija. Cengage mācīšanās. ISBN 978-0534278281.